初めての記事は熱発火理論について書いていこうと思います。
熱発火理論は発熱速度と冷却速度の熱収支から物質の発火性、熱暴走性を考えるものになります。
化学物質の発熱速度は温度に依存して指数的に増加します。話を簡単にするために、ここは0次の反応を仮定します。
Arrhenius式に従う反応の反応速度は下記の式で表されます。
Qex = A × exp (-Ea / RT) × ΔH
Qex:発熱速度 A:頻度因子 Ea:活性化エネルギー R:気体定数 ΔH:反応熱
下の図では赤い曲線で表しています。
一方で冷却速度はニュートンの冷却則に従い、その冷却速度は下記の式で表されます。
Qcl = U × A’ × (T – Tα)
Qcl:冷却速度 U:総括伝熱係数 A’:冷却面積 Tα:環境温度
下の図では青い直線で表しています。
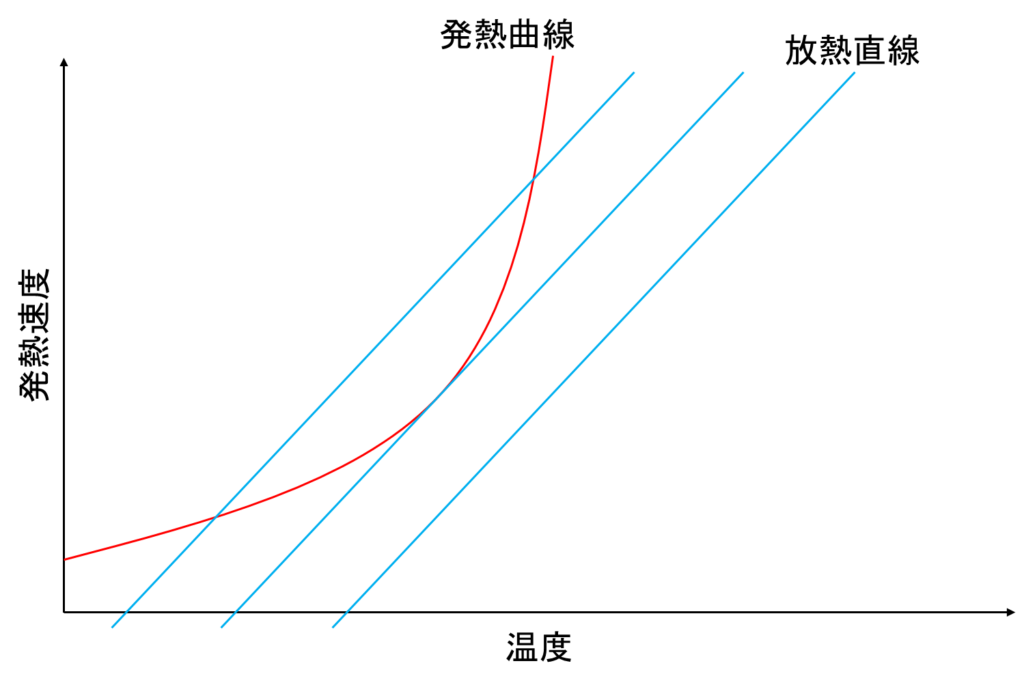
発熱速度は温度の上昇に伴い、指数関数的に増大していきます。
一方で冷却速度は一次関数のため、温度が上がっても一定の傾きを維持します。
発熱曲線に対し、図の左と中央の直線は交わる点があり、
熱収支が等しくなるため運転可能な温度領域があることがわかります。
しかし、右の直線についてはどの温度においても交わる点がなく、この場合系の温度が上昇を続け、
温度が上がって結果、反応速度がさらに上昇する反応暴走へ繋がります。
プロセスの設計、スケールアップを行う際には、このように熱収支を考慮する必要があります。
また、設計時には問題がなくても、以下の要因により熱収支が崩れる恐れがあります。
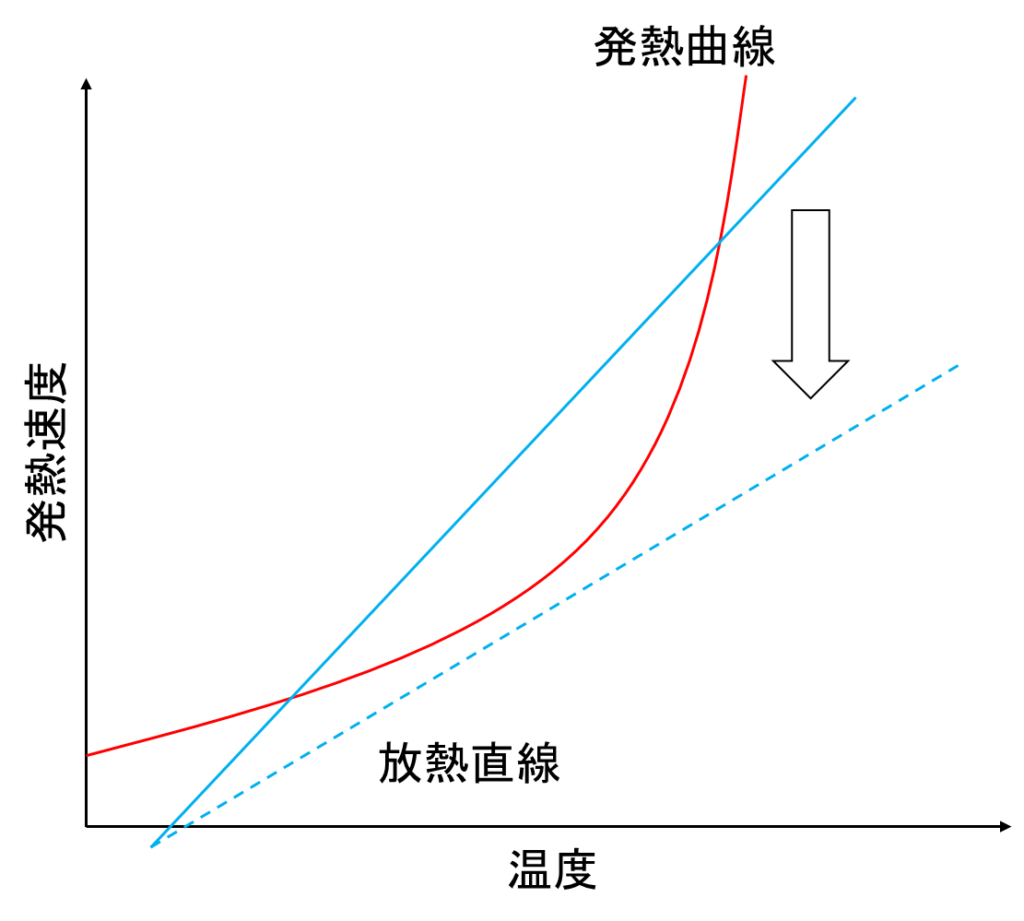
①冷却能力の低下
ニュートンの冷却則におけるUは熱伝達率であり、熱の伝わりやすさを表した値です。
プラントを長期間運転していると、冷却水に含まれる硬度成分(カルシウム等)のスケールが付着したり、
重合物や副生成物が壁面に付着し、熱が伝わりにくくなる、つまりは熱伝達率が小さくなり、
冷却直線が変化することがあります。

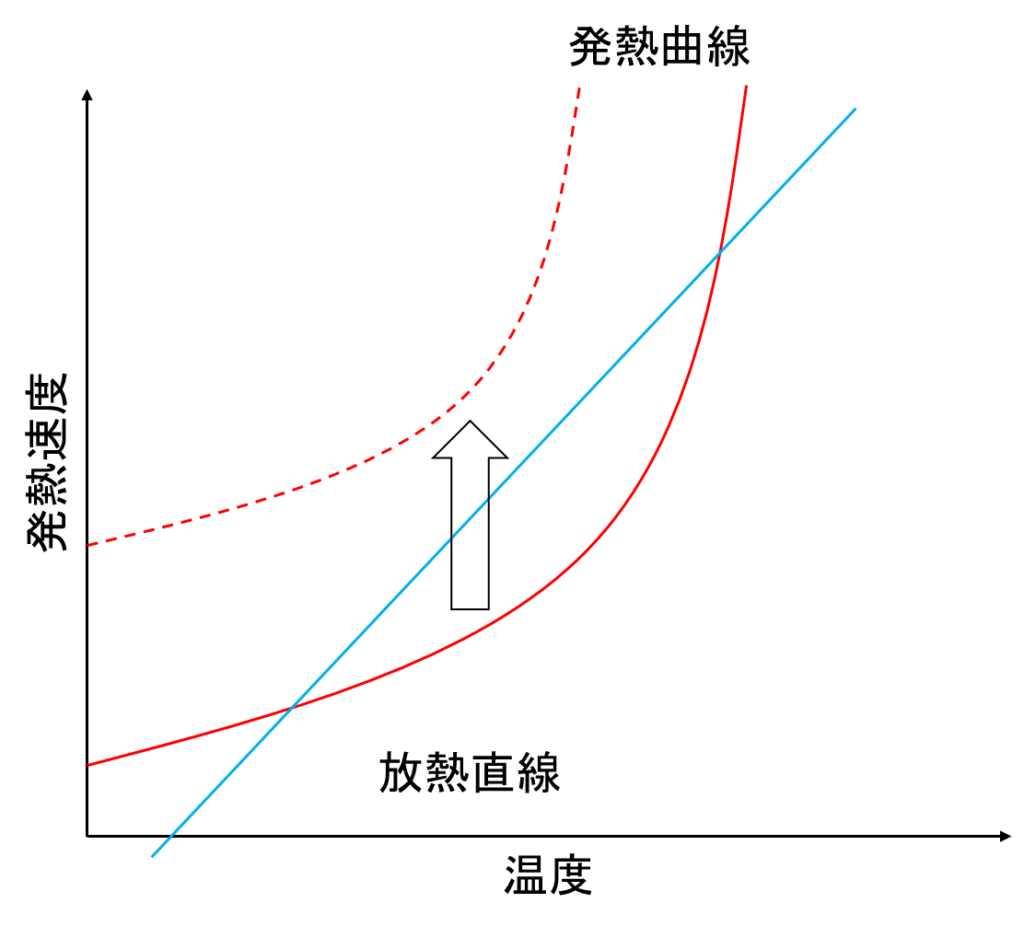
②発熱速度の増加
触媒をバッチで投入するプロセスの場合、触媒を誤って入れすぎてしまったことによる、反応速度の増加があります。
【参考文献】
化学プロセスの熱的リスク評価
